Δείτε το βίντεο της ΑΓΩΓΗΣ με τον Μάριο:
http://https://www.youtube.com/watch?v=EEDje_ttDlE

Σεπ 29
Δείτε το βίντεο της ΑΓΩΓΗΣ με τον Μάριο:
http://https://www.youtube.com/watch?v=EEDje_ttDlE
Σεπ 29
Παρακολουθείστε το πιο κάτω βίντεο:
http://https://www.youtube.com/watch?v=rCzW7PdTf9Y
Οι Έλληνες υγειονομικοί που είχαν προσφύγει στο Ευρωπαϊκό Δικαστήριο Ανθρωπίνων Δικαιωμάτων κατακρίνουν την απόφαση του Δικαστηρίου να απορρίψει τα ασφαλιστικά μέτρα που ζήτησαν σχετικά με την υποχρεωτικότητα του εμβολιασμού στον κλάδο τους. Οι 30 υγειονομικοί (Οδοντίατροι, Ορθοδοντικοί, Παιδοδοντίατροι, Νοσηλευτές, Νοσηλεύτριες, Διασώστες του ΕΚΑΒ, Παιδίατροι, Ορθοπεδικοί, Μικροβιολόγοι, Γυναικολόγοι) που αντιδρούν στο μέτρο αναφέρουν ότι η απόφαση του ΕΔΑΔ (Ευρωπαϊκού Δικαστηρίου Ανθρωπίνων Δικαιωμάτων) αφορά στην απόρριψη ακρόασης των ασφαλιστικών μέτρων και όχι στην απόρριψη των μέτρων της υποχρεωτικότητας – της ουσίας δηλαδή -, ενώ κάνουν λόγο για «πρωτοφανή αντισυνταγματικό και αντιεπιστημονικό νόμο της ελληνικής κυβέρνησης». Το zougla.gr είχε μια μακρά συζήτηση με τους εκπροσώπους τους, στην οποία τους ζητήσαμε να μας δώσουν διευκρινίσεις για τη νομική τους ενέργεια, όσο και να μας εξηγήσουν τους λόγους για τους οποίους αντιτίθενται στην υποχρεωτικότητα του εμβολιασμού για τον κλάδο τους.
Στη συζήτηση στο βίντεο συμμετείχαν οι οδοντίατροι Ζαφειρία Κακαλέτρη και Νίκος Βακολίδης, καθώς και η νομικός τους εκπρόσωπος Στέλλα Χασάπη.
Πηγή:https://www.zougla.gr/greece/article/…
Σεπ 28
The World Economic Forum recently posted a video with the caption “Take a peek at the future”. Evidently, the future they want is a dystopian nightmare where dehumanization is taken to absurd levels.

As you probably know, since 2020, this pandemic has poisoned the lives of billions of individuals across the world. Meanwhile, the World Economic Forum (WEF) cannot contain its excitement. Indeed, this powerful, influential, elite-owned organization keeps posting bizarrely upbeat videos about the “advantages” and “opportunities” of COVID-19.
For instance, in January, the WEF posted a video titled “What is the Great Reset” which basically acknowledges that it’s using the pandemic to bring about a new social and economic order … while making fun of those who predicted that would happen. A month later, the WEF posted another video titled “Lockdowns Are Quietly Improving Cities Across the World” which was nothing less than insane. In fact, the WEF eventually deleted that video … but that doesn’t mean they don’t believe it.
Needless to say, people absolutely hate these videos. They are ruthlessly downvoted on YouTube and 99.85% of the comments express utter disgust. But that did stop the WEF from creating more absurdities.
On August 17th, the WEF posted a video titled “This is how our lives would soon look”. And it looks likes the trailer of a dystopian horror movie where people are treated like dehumanized cattle.
Here’s the video:
The first thing they make abundantly clear is that they don’t want you or your children to leave the house. They want you to work from home and they want your children to learn from home. And they believe that these changes will be so permanent that offices will need to be repurposed and entire neighborhoods will need to be redesigned.
They don’t even want you to leave the house to get food. Also, they want you to wear a mask in your own house when you get that food. “Analytics-driven services” implies that big tech companies will analyze your web searches and consuming habits to “predict” what you want and have it sent to you:

Same thing:
If you decide to go crazy and actually get out of the house to meet other people, they want it to be like this:
If you meet another human being, it’s going to be with hand sanitizer and permanent masks. Don’t forget to scan that QR code so they know exactly where you are and who you are meeting with.
They’ll also want to track you in the creepiest way possible.
I hate every word in this sentence.
According to the WEF, masks will be a permanent thing. And, because of that, their precious face recognition systems won’t work as well. So what’s the solution? Stop with the masks because pandemics are temporary? Of course not. Stop with the tracking of individuals? Are you crazy? Their answer: Shoot lasers right at our hearts and listen to our heartbeats to ID us. Yes, that’s the most insane answer to that question and that’s what they put in their video.
These creeps are also “laser-focused” on our children. They want to shape and mold them according to their dystopian principles. For this reason, the WEF promotes permanent remote learning on screens.
They want your children to be locked inside the house, staring at screens all day.
Although remote learning has been nothing less than disastrous for the development and mental well-being of children, the WEF wants it to become permanent. And to sell that insane idea, they claim that it would “improve their digital skills”.
That’s the weakest argument I’ve ever heard regarding anything in my life. Children today absolutely do not need to “improve their digital skills”. They learn how to use phones and tablets before they actually learn how to walk. If anything, they need to scale back their “digital skills” by a couple of notches and boost their “go outside and get dirty” skills by a couple of notches.
The WEF knows very well that children need to play, socialize and communicate with other children to develop properly. However, they do not want children to develop properly. That’s the scary, terrifying truth about their agenda. They’re looking to deny vital elements of a child’s development in order to create the kind of human they want living in their dystopian society.
They really want COVID hysteria to be permanent.
Not unlike previous WEF videos, this one was received with universal disgust. Here are some Twitter replies to the video (I didn’t cherrypick them, they’re literally all like that).
Absolute must-read: No Privacy, No Property: The World in 2030 According to the World Economic Forum
As you might have noticed, these videos aggravate me, like they aggravate nearly everyone who watches them. And for several reasons. First, who voted for any of this? Did anyone see the name of Klaus Schwab – the head of the WEF – on any election ballot? Of course not. In fact, Schwab has been working for years to dismantle national democracies.
“Schwab as publisher of the World Economic Forum’s 2010 “Global Redesign” report postulates that a globalized world is best managed by a coalition of multinational corporations, governments (including through the UN system) and select civil society organizations (CSOs). It argues that governments no longer are “the overwhelmingly dominant actors on the world stage” and that “the time has come for a new stakeholder paradigm of international governance”. The WEF’s vision includes a “public-private” UN, in which certain specialized agencies would operate under joint State and non-State governance systems.
“According to the Transnational Institute (TNI), the Forum is hence planning to replace a recognised democratic model with a model where a self-selected group of ‘stakeholders’ make decisions on behalf of the people. The think tank summarises that we are increasingly entering a world where gatherings such as Davos are “a silent global coup d’etat” to capture governance.” – Wikiepdia, Klaus Schwab
Second, every single WEF video unironically promotes a joyless, freedomless world where everything that makes life worth living is banned.
They want you to stay in your house while they extract what they need from you using technology. They want to train your children to be the same. They don’t want you to wander too far from your home and, if you do, they want to track you on a biological level.
They especially don’t want you to interact with other human beings in a normal way because that might spark some humanity in you.
Is this how you want to live? Is this the world you want your children to grow up in? If not, we need to actively reject every attempt to make their plans a reality, on every level possible.
Source: VigilantCitizen.com
Σεπ 28
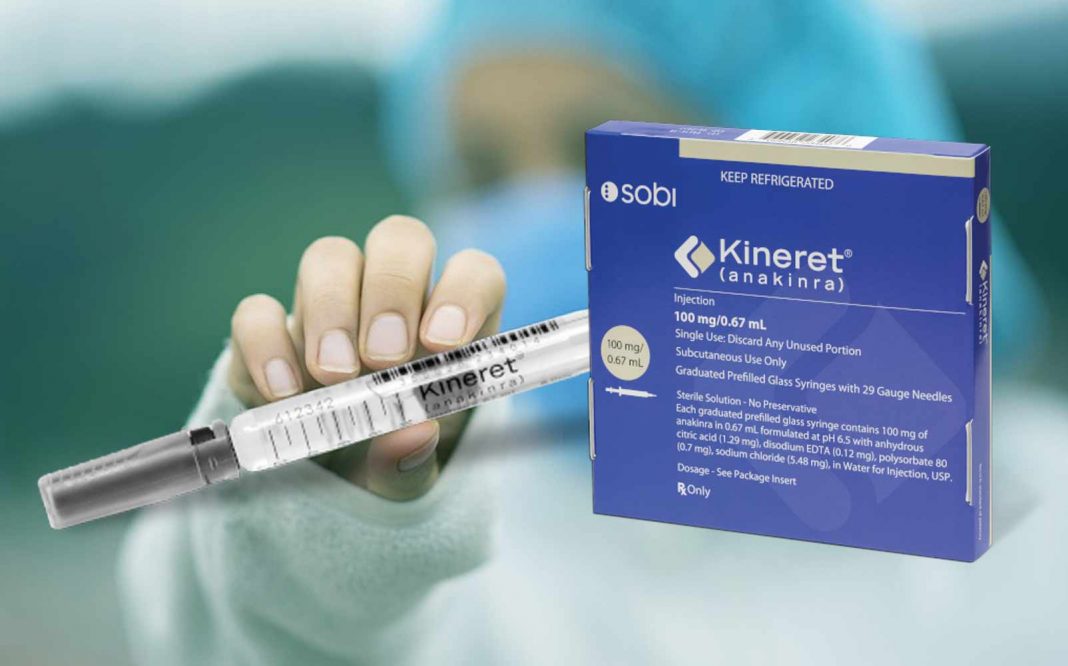
Το KINERET (ένας ανοσοκατασταλτικός παράγοντας) είναι ένας τύπος κυτοκίνης που χρησιμοποιείται για τη θεραπεία της ρευματοειδούς αρθρίτιδας.
Το ανακίνρα (anakinra) εξουδετερώνει τη βιολογική δραστικότητα της ιντερλευκίνης-1α και της ιντερλευκίνης-1β αναστέλλοντας ανταγωνιστικά τη δέσμευσή τους στον υποδοχέα τύπου Ι της ιντερλευκίνης-1 (IL-1RI). Η ιντερλευκίνη-1 (IL-1) είναι μία βασική προ-φλεγμονώδης κυτοκίνη, η οποία μεσολαβεί σε πολλές κυτταρικές αποκρίσεις, συμπεριλαμβανομένων εκείνων που είναι σημαντικές στην αρθρική φλεγμονή.
Σεπ 28
Nature Medicine (2021)
Early increase of soluble urokinase plasminogen activator receptor (suPAR) serum levels is indicative of increased risk of progression of coronavirus disease 2019 (COVID-19) to respiratory failure. The SAVE-MORE double-blind, randomized controlled trial evaluated the efficacy and safety of anakinra, an IL-1α/β inhibitor, in 594 patients with COVID-19 at risk of progressing to respiratory failure as identified by plasma suPAR ≥6 ng ml−1, 85.9% (n = 510) of whom were receiving dexamethasone. At day 28, the adjusted proportional odds of having a worse clinical status (assessed by the 11-point World Health Organization Clinical Progression Scale (WHO-CPS)) with anakinra, as compared to placebo, was 0.36 (95% confidence interval 0.26–0.50). The median WHO-CPS decrease on day 28 from baseline in the placebo and anakinra groups was 3 and 4 points, respectively (odds ratio (OR) = 0.40, P < 0.0001); the respective median decrease of Sequential Organ Failure Assessment (SOFA) score on day 7 from baseline was 0 and 1 points (OR = 0.63, P = 0.004). Twenty-eight-day mortality decreased (hazard ratio = 0.45, P = 0.045), and hospital stay was shorter.
COVID-19 can have an unpredictable clinical course. Patients might suddenly deteriorate into severe respiratory failure, defined as a respiratory ratio (partial oxygen pressure (PaO2)/fraction of inspired oxygen (FIO2)) below 150 mmHg, necessitating non-invasive ventilation (NIV) or mechanical ventilation (MV). Early recognition of patients at risk of progressing to severe disease and timely onset of targeted treatment are of utmost importance.
Research by our group and others has shown that suPAR is a biomarker that predicts progression to severe respiratory failure or death in patients with COVID-19. suPAR is increased earlier in disease progression than other biomarkers, including C-reactive protein (CRP), interleukin (IL)-6, ferritin and D-dimers1,2. suPAR denotes the presence of danger-associated molecular patterns (DAMPs), namely calprotectin (S100A8/A9) and IL-1α3,4, both of which contribute to pathogenic inflammation in COVID-19. Calprotectin stimulated aberrant production of IL-1β by circulating monocytes4, and inhibition of IL-1α prevented the development of strong pro-inflammatory responses in a COVID-19-like animal model3. Early elevations in suPAR signify risk of progression to severe respiratory failure or death and also refractoriness to full recovery1,2. These observations led us to propose a two-step strategy for managing patients with COVID-19, which used elevated suPAR levels to first identify patients at risk of progressing to severe respiratory failure or death and then to initiate early targeted treatment with anakinra, a recombinant IL-1 receptor antagonist that blocks the activity of both IL-1α and IL-1β. The open-label, phase 2 SAVE study was conducted as a proof of concept for this approach5. Results showed a 70% decrease in the relative risk of progression to severe respiratory failure and a significant reduction in 28-d mortality with anakinra treatment compared to standard of care.
The SAVE-MORE study (suPAR-guided Anakinra treatment for Validation of the risk and Early Management Of seveRE respiratory failure by COVID-19) is a pivotal, confirmatory, phase 3, double-blind randomized controlled trial that evaluated the efficacy and safety of early initiation of anakinra treatment in hospitalized patients with moderate or severe COVID-19. The primary objective was to evaluate the efficacy and safety of early anakinra administration on the 11-point ordinal WHO-CPS on day 28 from the start of treatment.
From 23 December 2020 to 31 March 2021, 1,060 patients with molecular definition of COVID-19 by positive polymerase chain reaction (PCR) for severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) were screened, and 606 were randomized at 37 study sites (Methods). The main reason for exclusion from the study was suPAR <6 ng ml−1. Twelve patients withdrew consent and requested removal of all data, leaving a final intention-to-treat (ITT) analysis cohort of 594 patients. All patients received standard of care; 189 patients were allocated to the placebo arm; and 405 patients were allocated to the anakinra arm. Only one patient was lost to follow-up (Fig. 1). Baseline characteristics and co-administered treatments were similar between the two treatment arms (Table 1). Overall, 91.6% of patients had severe pneumonia as defined by the WHO classification for COVID-19. Patients not on dexamethasone at baseline started dexamethasone in compliance with standard of care after the start of the study drug.
IV, intravenous.
The distributions of patient scores on the 11-point WHO-CPS in the two treatment arms at day 28 (primary outcome) are shown in Table 2 and Fig. 2a. In brief, 50.4% (204/405) of patients receiving anakinra had fully recovered with no viral RNA detected on day 28 compared to 26.5% (50/189) of patients receiving placebo, and 3.2% (13/405) and 6.9% (13/189) of patients in the anakinra and placebo arms, respectively, died. Overall, the unadjusted proportional odds of having a worse score on the 11-point WHO-CPS at day 28 with anakinra was 0.36 versus placebo (95% confidence interval (CI) 0.26–0.49, P < 0.0001; ordinal regression analysis) (Fig. 2a). The assumptions of the ordinal regression analysis—that is, the goodness-of-fit test and the parallel lines test—were not statistically significant, indicating that there was a high likelihood of the treatment effect size being homogeneous for all 11 points of the WHO-CPS.
a, Distribution of the WHO-CPS scores at day 28 of patients allocated to treatment with placebo and to treatment with anakinra. Comparison is done by unadjusted ordinal regression analysis; the ORs of the 95% CIs are provided. The exact P value of the unadjusted ordinal regression analysis is 3.6 × 10−10. The two tests of the assumptions of the ordinal regression analysis are also provided. b, Univariate and multivariate ordinal regression analysis of the WHO-CPS scores at day 28. The exact P value of the effect of anakinra versus placebo treatment in the multivariate analysis is 7.7 × 10−10. Covariates entered in the multivariate model were those used for stratified randomization according to advice received from the COVID-ETF. ECMO, extracorporeal membrane oxygenation; P/F, respiratory ratio.
Multivariate ordinal regression analysis of the primary outcome was performed using the stratification factors for randomization as independent variables—that is, disease severity, intake of dexamethasone, body mass index (BMI) >30 kg m−2 and country (Fig. 2b). Results of the univariate analysis showed that dexamethasone treatment and baseline severe COVID-19 were associated with higher odds, and anakinra treatment with lower odds, of a worse (higher) WHO-CPS score at day 28. Of note, the observed higher odds of a worse outcome with dexamethasone likely reflects the administration of dexamethasone to patients with severe pneumonia rather than a true detrimental effect of dexamethasone. In the multivariate analysis, treatment with anakinra was the only independent variable associated with the primary outcome. Compared to placebo, the adjusted proportional odds of having a worse score on the 11-point WHO-CPS at day 28 with anakinra was 0.36 (95% CI 0.26–0.50, P < 0.0001) (Fig. 2b).
Three pre-specified confirmatory analyses of the primary endpoint were performed: (1) comparison of patients’ WHO-CPS score distributions in the anakinra versus placebo arms at day 14; (2) analysis of the proportion of patients with persistent disease at day 28 in each treatment arm (no disease persistence defined as full recovery with no viral RNA detected, WHO-CPS score of 0; persistent disease defined as WHO-CPS score ≥1) and of the proportion of patients with severe disease or who were dead at day 28 in each treatment arm (WHO-CPS score ≥6); and (3) analysis of the progression to severe respiratory failure (defined as respiratory ratio <150 mm Hg, necessitating high-flow oxygen (HFO), NIV or MV) or death by day 14. All three confirmatory analyses fully supported the clinical benefit of anakinra treatment. Compared to placebo, the unadjusted proportional odds of having a worse score on the 11-point WHO-CPS at day 14 with anakinra was 0.57 (95% CI 0.42–0.77, P < 0.0001) (Extended Data Fig. 1). After multivariate adjustment using the stratification factors for randomization as covariates, the OR was 0.58 (95% CI 0.42–0.79, P = 0.001) (Supplementary Table 1), showing that treatment with anakinra was an independent variable associated with clinical benefit compared to placebo at day 14. Multivariate logistic regression analysis of persistent disease at day 28 indicated that severe COVID-19 at baseline significantly increased the risk of disease persistence, whereas treatment with anakinra significantly reduced the risk (OR of WHO-CPS ≥1, anakinra versus placebo: 0.36; 95% CI 0.25–0.53, P < 0.0001) (Supplementary Table 2). In addition, treatment with anakinra significantly reduced the risk of severe disease or death at day 28 (OR of WHO-CPS ≥6, anakinra versus placebo: 0.46; 95% CI 0.26–0.83, P = 0.010) (Supplementary Table 2). The third confirmatory analysis validated the results of the phase 2 SAVE trial. A lower proportion of patients treated with anakinra progressed to severe respiratory failure or death by day 14 compared to placebo (20.7% versus 31.7% in the anakinra and placebo arms, respectively; hazard ratio = 0.62, 95% CI 0.45–0.87, P = 0.005) (Extended Data Fig. 2 and Supplementary Table 3). Finally, survival analysis showed that anakinra treatment significantly reduced the risk of death by day 28 compared to placebo (3.2% versus 6.9% in the anakinra and placebo arms, respectively; hazard ratio = 0.45, 95% CI 0.21–0.98, P = 0.045) (Extended Data Fig. 3).
The 11 points of the WHO-CPS are also grouped into five strata. Although, in the original protocol, it was considered to compare the frequency of strata between the two arms, the statistical analysis plan (SAP) developed with the COVID-19 Emergency Task Force (COVID-ETF) of the European Medicines Agency (EMA) pre-defined the use of the entire 11-point WHO-CPS. The comparison of outcomes using the WHO-CPS strata (uninfected (0), ambulatory with mild disease (1–3), hospitalized with mild disease (4,5), hospitalized with severe disease (6–9) and dead (10)) between the two study arms (Supplementary Tables 4 and 5) was also consistent with the analysis performed using the full 11-point scale of the WHO-CPS.
The rate of protocol deviations from the standard of care treatment was significantly greater in patients randomized to the placebo arm (27/189, 14.3% versus 13/405, 3.2% in the anakinra arm; P < 0.0001). Protocol deviations regarding dexamethasone use in the placebo arm were most commonly related to increasing the dose and/or lengthening the duration of administration (Supplementary Table 6). All five sensitivity analyses confirmed the analysis of the primary endpoint (Supplementary Table 7).
A significant benefit with anakinra treatment was observed for all five secondary clinical endpoints. Decreases in WHO-CPS score from baseline by days 28 and 14 and Sequential Organ Failure Assessment (SOFA) score from baseline by day 7 were significantly greater with anakinra versus placebo (Table 2 and Supplementary Tables 8–10). Moreover, in the anakinra group, mean time until hospital and intensive care unit (ICU) discharge was 1 and 4 d shorter, respectively (Table 2 and Extended Data Figs. 4 and 5).
Over-time follow-up of laboratory values showed that, in patients who were treated with anakinra compared to patients who received placebo: (1) the absolute lymphocyte count was significantly increased by day 7; (2) circulating IL-6 levels were significantly decreased by days 4 and 7; and (3) plasma CRP levels were significantly decreased by day 7 (Fig. 3).
Day 1 sampling was done before start of administration of the study drug. The two-sided P values of comparisons for each day of follow-up are provided. The comparisons were performed by the Mann–Whitney U test. The lower whisker indicates the 95% lower CI; the lower bound of the box indicates the first quartile; the center of the box indicates the median; the upper bound of the box indicates the third quartile; and the upper whisker indicates the 95% upper CI. Circles represent outliers. a, The respective number of measurements of the absolute lymphocyte count of day 1 for placebo and anakinra were for 184 and 387 patients; minimum values were 782 and 799 per mm3 and maximum values were 1,008 and 1,238 per mm3. The respective number of measurements of the absolute lymphocyte count of day 4 for placebo and anakinra were for 176 and 386 patients; minimum values were 1,008 and 1,114 per mm3 and maximum values were 1,183 and 1,938 per mm3. The respective number of measurements of the absolute lymphocyte count of day 7 for placebo and anakinra were for 171 and 377 patients; minimum values were 1,216 and 1,386 per mm3 and maximum values were 1,446 and 1,551 per mm3. b, The respective number of measurements of IL-6 of day 1 for placebo and anakinra were for 182 and 394 patients; minimum values were 1.4 and 0.4 pg ml−1 and maximum values were 6,263.0 and 418.9 pg ml−1. The respective number of measurements of IL-6 of day 4 for placebo and anakinra were for 176 and 381 patients; minimum values were 1.4 and 1.4 pg ml−1 and maximum values were 1,352.0 and 1,209.0 pg ml−1. The respective number of measurements of IL-6 of day 7 for placebo and anakinra were for 167 and 376 patients; minimum values were 1.4 and 1.4 pg ml−1 and maximum values were 1,900.0 and 867.5 pg ml−1. c, The respective number of measurements of CRP of day 1 for placebo and anakinra were for 183 and 404 patients; minimum values were 0.9 and 0.8 mg L−1 and maximum values were 328.8 and 411.9 mg L−1. The respective number of measurements of CRP of day 4 for placebo and anakinra were for 180 and 393 patients; minimum values were 0.40 and 0.41 mg L−1 and maximum values were 272.3 and 274.0 mg L−1. The respective number of measurements of CRP of day 7 for placebo and anakinra were for 174 and 381 patients; minimum values were 0.5 and 0.1 mg L−1 and maximum values were 226.5 and 145.1 mg L−1.
The frequency of patients with at least one serious treatment-emergent adverse event (TEAE) was 21.7% (41/189) in the placebo arm and 16.0% (65/405) in the anakinra arm (Table 3 and Supplementary Table 11). The most common captured serious TEAEs were infections, but they were less frequent in the anakinra arm than the placebo arm (34/405, 8.4% versus 30/189, 15.9%). The next most common serious TEAEs were ventilator-associated pneumonia (9/405, 2.2% versus 15/189 7.9%); septic shock and multiple organ dysfunction (6/405, 1.5% versus 7/189, 3.7%); bloodstream infections (12/405, 3.0% versus 6/189, 3.2%); and pulmonary embolism (6/405, 1.5% versus 4/189, 2.1%). The most common non-serious TEAEs were the increase of liver function tests (145/405, 35.8% versus 63/189, 33%) and hyperglycemia (148/405, 36.5% versus 76/189, 40.2%), which were similar in frequency between the two arms. The frequency of non-serious anemia was lower in anakinra-treated patients (58/405, 14.3% versus 37/189, 19.6%). There was a trend for greater frequency of neutropenia with anakinra treatment (12/405, 3% versus 1/189, 0.5% in placebo) (Table 3 and Supplementary Table 12).
Although no differences between the two arms were found for baseline values of IL-6 (P = 0.22), ferritin (P = 0.59) and respiratory ratio (P = 0.10), multivariate analysis of the 28-d WHO-CPS was repeated post hoc including, as independent variables, IL-6, ferritin and respiratory ratio. For this analysis, the three variables were dichotomized using their median value. The intake of remdesivir was also included as an independent variable. Results confirmed anakinra benefit (Supplementary Table 13).
One hundred forty-six patients had low baseline CRP (below the first quartile of 25.3 mg L−1)6; several of these patients had low lymphocytes and increased IL-6, ferritin and suPAR (Supplementary Table 14). Clinical benefit of anakinra was found in patients with low CRP (Supplementary Table 15).
Four hundred eighty-seven patients had scores of 2 or more points for the COVID-associated hyper-inflammation syndrome score;7 multivariate ordinal regression analysis of WHO-CPS on day 28 for these patients showed overall anakinra benefit (Supplementary Table 16). A survival benefit was also found (28-d mortality of 13/337 patients, 3.9% versus 13/150 patients, 8.7%; Extended Data Fig. 6). Two hundred ten patients met the predictive criteria for cytokine storm,8 and an anakinra benefit was found (28-d mortality of 5/146 patients, 3.4% versus 10/64 patients, 15.6%; Supplementary Table 17 and Extended Data Fig. 7).
Predictors of favorable response to anakinra were defined using cutoffs of laboratory parameters that can predict progression to severe respiratory failure or death after 14 d (Extended Data Fig. 8). A combination of at least two of CRP >50 mg L−1, neutrophil-to-lymphocyte ratio (NLR) >5.5, ferritin >700 ng ml−1 and aspartate aminotransferase (AST) > 44 U L−1 might predict this unfavorable outcome (Supplementary Table 18). Patients with levels above these cutoffs had lower odds of progression to severe respiratory failure or death if they received anakinra (Supplementary Table 19).
We collected post hoc information for the 14-d outcome of patients with suPAR <6 ng ml−1; only 2.9% of patients progressed to severe respiratory failure or death.
The SAVE-MORE trial evaluated a novel approach for the management of COVID-19, which relies on early identification of patients at risk for unfavorable outcome using suPAR and provision of targeted treatment with anakinra. Results showed considerable efficacy of 10-d subcutaneous administration of anakinra in patients with COVID-19 with plasma suPAR ≥6 ng ml−1. The odds of a worse clinical outcome at day 28 with anakinra, as compared to placebo, was 0.36. The clinical benefit with anakinra treatment was already apparent from day 14, and this is of clinical importance because the first 14 d is the period during which a patient is expected to worsen; anakinra benefit was maintained until day 28. The magnitude of the efficacy of anakinra was shown in all multivariate analyses where in the presence of anakinra treatment the effect of baseline disease severity on the final outcome was lost. The proportion of patients who fully recovered exceeded 50%, and the number of patients who remained with severe disease was reduced by 54%. Most of the study population had severe COVID-19 at baseline, and 85.9% were receiving standard of care treatment containing dexamethasone. Relative decrease of mortality was 55% and reached 80% for patients likely having cytokine storm8. The incidence of serious TEAEs, mainly of infections, was lower in patients treated with anakinra. Patients treated with anakinra had a trend for more often non-serious neutropenia.
Two main limitations of the SAVE-MORE trial need to be acknowledged: the lack of enrollment of patients with critical COVID-19 and the difficulty for application of suPAR in all hospital settings. Not all hospitalized patients with COVID-19 have as high risk of mortality as patients progressing to critical illness, who were included in the REMAP-CAP and RECOVERY trials9,10. This was further confirmed in the STOP-COVID11 and CAN-COVID12 trials where the 28-d mortality of placebo-treated patients with non-critical COVID-19 ranged from 5.5% to 7.2%. The low mortality in these studies might reflect an improvement of outcomes with the current standard of care compared to the beginning of the pandemic. Results of the SAVE-MORE trial indicated that suPAR is an indicator not only of the risk of progression to severe respiratory failure or death but also of persistence of COVID-19. Most patients who received placebo remained ambulatory with symptoms on day 28. The introduction of suPAR to guide treatment could be problematic in settings where this tool is not available. Measuring suPAR is introducing a personalized treatment approach, because early increase of suPAR is indicative of excess release of DAMPs, leading to pro-inflammatory phenomena through activation of IL-1α/β3. Anakinra blocks both IL-1α and IL-1β by blocking their common receptor. The attenuation of the inflammatory responses by anakinra was shown by the decrease of IL-6 and of CRP circulating concentrations and by the increase of the absolute lymphocyte counts. Post hoc analysis revealed that CRP, NLR, ferritin and AST are predictors of favorable anakinra response and might also be used instead of suPAR.
CRP and ferritin are used to classify COVID-19 hyper-inflammation and work also as predictors of treatment escalation6. In the SAVE-MORE study, some patients enrolled because of increased suPAR had low CRP; anakinra benefit was found even when CRP was low.
The results validate the findings of the previous SAVE open-label phase 2 trial. In SAVE, the incidence of respiratory failure after 14 d with anakinra treatment was 22.3%5; in the SAVE-MORE trial, it was 20.7%. For patients in SAVE-MORE who were eventually admitted to the ICU, time until discharge was significantly shorter in the anakinra-treated group than in the placebo group, as was also observed in the SAVE trial5.
Since the beginning of the COVID-19 pandemic, immunomodulators have been suggested as a strategy to attenuate the exaggerated immune response of the host13. The most common administered drugs are anakinra and tocilizumab, targeting the IL-1 and IL-6 pathways, respectively. Anakinra use in COVID-19 has been reported in several retrospective and prospective studies, as well as in one randomized controlled trial5,14,15,16,17,18,19,20,21. Although most studies report mortality benefit, it is difficult to compare findings from observational studies with those of the SAVE-MORE trial. Previous studies differed with regard to selection of patients, severity of illness and stage of the disease. Duration of treatment, dose and route of administration were also variable, and the WHO-CPS was not studied as a primary endpoint. Indeed, four of the studies were done in patients with critical illness, with plasma levels of CRP and ferritin exceeding the levels of the SAVE-MORE study population14,15,16,17,18. In the CAN-COVID trial, 454 patients with hypoxic COVID-19 not requiring MV and with signs of hyper-inflammation were randomized to a single injection of placebo or the anti-IL-1β monoclonal antibody canakinumab12. The trial failed to meet the primary endpoint—namely, the rate of survivors not in need of NIV or MV by day 29. The differential findings of SAVE-MORE could be explained by the activity of anakinra against IL-1α, which is not inhibited by canakinumab. An alternative explanation for this discrepancy is that patient stratification in CAN-COVID used CRP or ferritin instead of suPAR as biomarkers of hyper-inflammation.
The clinical benefit of tocilizumab has been studied in six clinical trials. Τhe patient populations of four clinical trials were much similar to the population of the SAVE-MORE trial22,23,24,25. Clinical benefit from tocilizumab treatment was shown in only one trial23. Conversely, clinical benefit from tocilizumab treatment was found in the RECOVERY9 and REMAP-CAP10 trials, which included patients with severe and critical COVID-19. In the RECOVERY trial9, mortality was decreased from 35% with usual care to 31%, and, in the REMAP-CAP trial10, the median number of organ support-free days was increased from 0 d with usual care to 10 d with tocilizumab treatment. The benefit of tocilizumab in patients with more severe disease might be explained by the biology of the disease course. We previously showed that circulating monocytes in critical COVID-19 present with complex immune dysregulation characterized by decreased efficiency of antigen presentation and inappropriate maintenance of the potential for excess cytokine production, which were restored upon exposure to tocilizumab26. Our findings suggest that suPAR should be measured upon admission of all patients with COVID-19 who do not need oxygen or who need nasal or mask oxygen, and that, if suPAR levels are 6 ng ml−1 or higher, anakinra treatment might be a suitable therapy. For patients with low respiratory ratio who need NIV or MV, tocilizumab might be the most appropriate drug of choice.
In conclusion, the SAVE-MORE trial showed that early start of treatment with anakinra guided by suPAR levels in patients hospitalized with moderate and severe COVID-19 significantly reduced the risk of worse clinical outcome at day 28.
SAVE-MORE is a prospective, double-blind randomized clinical trial conducted in 37 study sites (29 in Greece and eight in Italy). The protocol (available with the full text of this article) was finalized after advice from the COVID-ETF of the EMA (document EMA/659928/2020). The full SAP was developed through interactions with the EMA COVID-ETF before database lock; no amendment was needed.
The protocol was approved by the National Ethics Committee of Greece (approval 161/20) and by the Ethics Committee of the National Institute for Infectious Diseases Lazzaro Spallanzani, IRCCS, in Rome (1 February 2021) (EudraCT no. 2020-005828-11; ClinicalTrials.gov NCT04680949). The trial was sponsored by the Hellenic Institute for the Study of Sepsis (HISS) and funded, in part, by HISS and, in part, by Swedish Orphan Biovitrum (Sobi). HISS was responsible for the design, conduct, analysis and interpretation of data and the decision to publish. The laboratory of Immunology of Infectious Diseases of the 4th Department of Internal Medicine at ATTIKON University General Hospital served as the central laboratory. The data lock for all events until day 28 was done on 29 April 2021.
Inclusion criteria were as follows: (1) adult patients of either sex; (2) for women, unwillingness to remain pregnant during the study period; (3) confirmed infection by SARS-CoV-2 by molecular test; (4) findings in chest X-ray or chest computed tomography compatible with lower respiratory tract infection; (5) need for hospitalization; and (6) plasma suPAR ≥6 ng ml−1. Exclusion criteria were as follows: (1) any stage IV malignancy; (2) any do-not-resuscitate order; (3) ratio or partial oxygen pressure to fraction of inspired oxygen less than 150 mmHg; (4) need of NIV (CPAP or BPAP) or MV; (5) any primary immunodeficiency; (6) fewer than 1,500 neutrophils per mm3; (7) oral or intravenous intake of corticosteroids at a daily dose greater than or equal to 0.4 mg kg−1 of prednisone for a period longer than the last 15 d; (8) any anti-cytokine biological treatment, including JAK inhibitors, during the last 1 month; (9) severe hepatic failure; (10) end-stage renal failure necessitating hemofiltration or peritoneal hemodialysis; and (11) pregnancy or lactation. All patients or their legal representatives provided written informed consent before enrollment.
Patients meeting all inclusion criteria and not meeting any exclusion criterion were subject to blood draw. suPAR was measured in plasma using the suPARnostic Quick Triage kit (Virogates) and a point-of-care reader. Patients with suPAR 6 ng ml−1 or higher were electronically 1:2 randomized into treatment with placebo or anakinra using four randomization strata: classification into moderate or severe disease using the WHO definition based on the need for oxygen support (https://www.who.int/publications/i/item/clinical-management-of-covid-19); need for dexamethasone intake; body mass index (BMI) higher than 30 kg m−2; and country. The 1:2 randomization was agreed with by the COVID-ETF of the EMA, taking into consideration the beneficial effect shown for anakinra in the phase 2 SAVE trial5, in the attempt to expose as few patients as possible to placebo. The study drug was administered subcutaneously once daily in the thigh or the abdomen for 7–10 d. The dose regimen and duration of treatment were based on the beneficial results of the same regimen in the phase 2 SAVE trial5. Patients allocated to placebo treatment were daily injected with 0.67 ml of 0.9% sodium chloride; patients allocated to the active drug were daily injected with 100 mg of anakinra at a final volume of 0.67 ml. The study drug was prepared by an unblinded pharmacist with access to the electronic study system using a separate username and password. Administration was done by a blinded study nurse. All patients were receiving pre-defined standard of care, which consisted of regular monitoring of physical signs, oximetry and anti-coagulation. Patients with severe disease by the WHO definition (https://www.covid19treatmentguidelines.nih.gov/concomitant-medications) were also receiving 6 mg of dexamethasone intravenously daily for 10 d. Remdesivir treatment was left at the discretion of the attending physicians; other biologicals targeting cytokines and kinase inhibitors were not allowed. All patients were allowed support with NIV or MV if needed.
Study visits were done daily for 10 d, on day 14 and on day 28. At each study visit, the following were recorded: non-serious and serious TEAEs, WHO-CPS score, SOFA score and co-administered treatment. Visits were done by phone for patients discharged by day 7. Data were captured after review of all medical and nursing charts by a physician team blinded to the allocation group. Blood samples and nasopharyngeal swabs were collected before start of the study drug and at days 4 and 7 for the measurement of biomarkers.
All serious and non-serious TEAEs were graded according to the Common Terminology Criteria for Adverse Events (v5.0).
The primary study endpoint was the overall comparison of the distribution of frequencies of the scores from the 11-point WHO-CPS between the two arms of treatment on day 28. Secondary endpoints included the changes of WHO-CPS scores at days 14 and 28 from the baseline (before start of the study drug); the change of SOFA score at day 7 from baseline; the time until hospital discharge; the time of stay in the ICU for patients eventually admitted to the ICU; and the comparison of biomarkers. The outcome by day 14 of patients excluded from enrollment because of suPAR lower than 6 ng ml−1 was captured post hoc.
The primary effect size was calculated based on the finding from the phase 2 SAVE trial5, in which there was a 25% difference between the two treatment arms in the number of patients who had scores of 6 or higher on the WHO-CPS by day 28 (42% of comparators versus 16.3% of anakinra-treated patients). To replicate this primary effect size in the SAVE-MORE trial, and with a 90% power at the 5% significance level, a sample size of 200 was needed for the placebo treatment arm and 400 for the anakinra treatment arm. Data were analyzed for the ITT population. Missing data were imputed by last observation carried forward (LOCF). WHO-CPS is an ordinal 11-point variable ranging from 0 to 10, and comparisons were done by univariate and multivariate ordinal regression analysis using the logit function. Results were expressed as the ORs and 95% CIs. The two basic assumptions of the model—namely, proportional odds and the goodness-of-fit test—were checked. According to advice from the EMA COVID-ETF, the variables used for stratified randomization—that is, disease severity, intake of dexamethasone, BMI higher than 30 kg m−2 and country—were entered as covariates in the multivariate model. According to the same advice, the analysis of the primary endpoint should have been supported by three analyses: comparison of WHO-CPS scores by day 14; logistic regression analysis separately for patients at the two spectra of the WHO-CPS at day 28; and time of progression to respiratory failure by day 14. The first spectrum of the WHO-CPS was defined as patients fully recovered with negative viral load (WHO-CPS 0 points); patients with persistent disease scored from 1 to 10 points on the WHO-CPS. The second spectrum was defined as patients with severe disease or who were dead scoring 6 or more points on the WHO-CPS, contrary to non-severe patients scoring 5 or fewer points. Time of progression to severe respiratory failure or death was compared by forward stepwise Cox regression analysis. Logistic stepwise analysis was used for the two spectra of the WHO-CPS. Survival analysis was done using Cox regression analysis. Five sensitivity analyses were conducted to assess robustness: exclusion of population deviating from the standard of care; population receiving at least seven doses of the study drug; complete analysis set; responder analysis treating missing values as non-responders; and comparison of the unadjusted and adjusted treatment effects. Analysis was conducted using IBM SPSS Statistics v26.0. All P values were two sided, and any P value less than 0.05 was considered statistically significant. The complete SAP is provided in the Supplementary Appendix. Although, in the original protocol, it was considered to compare the frequency of strata between the two arms, the SAP developed with the COVID-ETF pre-defined the use of the entire 11-point WHO-CPS before the database lock.
Further information on research design is available in the Nature Research Reporting Summary linked to this article.
Requests for de-identified patient data by researchers with proposed use of the data can be made to the corresponding author with specific data needs, analysis plans and dissemination plans. Those requests will be reviewed by a study steering committee and the study sponsor for release upon publication. Contact: egiamarel@med.uoa.gr. Source data are provided with this paper.
Rovina, N. et al. Soluble urokinase plasminogen activator receptor (suPAR) as an early predictor of severe respiratory failure in patients with COVID-19 pneumonia. Crit. Care 24, 187 (2020).
Azam, T. U. et al. Soluble urokinase receptor (suPAR) in COVID-19-related AKI. J. Am. Soc. Nephrol. 31, 2725–2735 (2021).
Renieris, G. et al. IL-1 mediates tissue specific inflammation and severe respiratory failure in Covid-19: clinical and experimental evidence. Preprint at medRxiv https://doi.org/10.1101/2021.04.09.21255190 (2021).
Rodrigues, T. S. et al. Inflammasomes are activated in response to SARS-CoV-2 infection and are associated with COVID-19 severity in patients. J. Exp. Med. 218, e20201707 (2021).
Kyriazopoulou, E. et al. An open label trial of anakinra to prevent respiratory failure in COVID-19. eLife 10, e66125 (2021).
Manson, J. J. et al. COVID-19-associated hyperinflammation and escalation of patient care: a retrospective longitudinal cohort study. Lancet Rheumatol. 2, e594–e602 (2020).
Webb, B. J. et al. Clinical criteria for COVID-19-associated hyperinflammatory syndrome: a cohort study. Lancet Rheumatol. 2, e754–e763 (2020).
Caricchio, R. et al. Preliminary predictive criteria for COVID-19 cytokine storm. Ann. Rheum. Dis. 80, 88–95 (2021).
RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet 397, 1637–1645 (2021).
Gordon, A. C. et al. Interleukin-6 receptor antagonists in critically ill patients with Covid-19. N. Engl. J. Med. 384, 1491–1502 (2021).
Guimarães, P. O. et al. Tofacitinib in patients hospitalized with COVID-19 pneumonia. N. Engl. J. Med. 385, 406–415 (2021).
Caricchio, R. et al. Effect of canakinumab vs placebo on survival without invasive ventilation in patients hospitalized with severe COVID-19. A randomized clinical trial. JAMA 236, 230–239 (2021).
Jamilloux, Y. et al. Should we stimulate or suppress immune responses in COVID-19? Cytokine and anti-cytokine interventions. Autoimmun. Rev. 19, 102567 (2020).
Bozzi, G. et al. Anakinra combined with methylprednisolone in patients with severe COVID-19 pneumonia and hyperinflammation: an observational cohort study. J. Allergy Clin. Immunol. 147, 561–566 (2021).
Cavalli, G. et al. Interleukin-1 and interleukin-6 inhibition compared with standard management in patients with COVID-19 and hyperinflammation: a cohort study. Lancet Rheumatol. 3, e253–e261 (2021).
Kooistra, E. J. et al. Anakinra treatment in critically ill COVID-19 patients: a prospective cohort study. Crit. Care 24, 688 (2020).
Cauchois, R. et al. Early IL-1 receptor blockade in severe inflammatory respiratory failure complicating COVID-19. Proc. Natl Acad. Sci. USA 117, 18951–18953 (2020).
Pontali, E. et al. Efficacy of early anti-inflammatory treatment with high doses of intravenous anakinra with or without glucocorticoids in patients with severe COVID-19 pneumonia. J. Allergy Clin. Immunol. 147, 1217–1225 (2021).
Huet, T. et al. Anakinra for severe forms of COVID-19: a cohort study. Lancet Rheumatol. 2, e393–e400 (2020).
CORIMUNO-19 Collaborative Group. Effect of anakinra versus usual care in adults in hospital with COVID-19 and mild-to-moderate pneumonia (CORIMUNO-ANA-1): a randomised controlled trial. Lancet Respir. Med. 9, 295–304 (2021).
Balkhair, A. et al. Anakinra in hospitalized patients with severe COVID-19 pneumonia requiring oxygen therapy: results of a prospective, open-label, interventional study. Int. J. Infect. Dis. 103, 288–296 (2021).
Rosas, I. O. et al. Tocilizumab in hospitalized patients with severe Covid-19 pneumonia. N. Engl. J. Med. 384, 1503–1516 (2021).
Salama, C. et al. Tocilizumab in patients hospitalized with Covid-19 pneumonia. N. Engl. J. Med. 384, 20–30 (2021).
Stone, J. H. et al. Efficacy of tocilizumab in patients hospitalized with Covid-19. N. Engl. J. Med. 383, 2333–2344 (2020).
Salvarani, C. et al. Effect of tocilizumab vs standard care on clinical worsening in patients hospitalized with COVID-19 pneumonia: a randomized clinical trial. JAMA Intern. Med. 181, 24–31 (2021).
Giamarellos-Bourboulis, E. J. et al. Complex immune dysregulation in COVID-19 patients with severe respiratory failure. Cell Host Microbe 27, 992–1000 (2020).
The authors wish to express their gratitude to the members of the Data Monitoring and Safety Committee and to M. Niederman, J. W. M. van der Meer and K. Reinhart for their valuable contributions and for their critical review of the submitted manuscript. This trial was sponsored by the Hellenic Institute for the Study of Sepsis (HISS) and funded, in part, by HISS and, in part, by Swedish Orphan Biovitrum (Sobi). HISS was responsible for the conceptualization and design of the study, data collection, analysis, decision to publish and preparation of the manuscript. Sobi had no role in study design, data collection and analysis, decision to publish or preparation of the manuscript.
G.P. has received independent educational grants from Pfizer, MSD, Angelini and Bio-Rad. H.M. reports receiving honoraria, consulting fees and non-financial support from healthcare companies, including Amgen, Angelini, Bayer, Mylan, MSD, Pfizer and Servier. L.D. received consultation honoraria from Sobi. M.B. has received funds for research grants and/or advisor/consultant and/or speaker/chairman from Angelini, Astellas, Bayer, bioMérieux, Cidara, Cipla, Gilead, Menarini, MSD, Pfizer, Roche, Shionogi and Nabriva. M.G.N. is supported by an ERC Advanced Grant (no. 833247) and a Spinoza grant of the Netherlands Organization for Scientific Research. He has also received independent educational grants from TTxD, GSK and ViiV Healthcare. J.E.-O. is a co-founder, shareholder and CSO of ViroGates, Denmark, and is a named inventor on patients on suPAR owned by Copenhagen University Hospital Hvidovre, Denmark. P.P. has received honoraria from Gilead, Janssen and MSD. G.N.D. is an advisor or lecturer for Ipsen, Pfizer, Genkyotex, Novartis and Sobi, has received research grants from Abbvie and Gilead and has served as principal investigator in studies for Abbvie, Novartis, Gilead, Novo Nordisk, Genkyotex, Regulus Therapeutics, Tiziana Life Sciences, Bayer, Astellas, Pfizer, Amyndas Pharmaceuticals, CymaBay Therapeutics, Sobi and Intercept Pharmaceuticals. E.J.G.-B. has received honoraria from Abbott, bioMérieux, Brahms, GSK, InflaRx, Sobi and XBiotech; independent educational grants from Abbott, AxisShield, bioMérieux, InflaRx, Johnson & Johnson, MSD, Sobi and XBiotech; and funding from the Horizon 2020 Marie-Curie Project European Sepsis Academy (granted to the National and Kapodistrian University of Athens) and the Horizon 2020 European Grants ImmunoSep and RISKinCOVID (granted to the Hellenic Institute for the Study of Sepsis). The other authors do not have any competing interests to declare.
Editor recognition statement: Jennifer Sargent was the primary editor on this article and managed its editorial process and peer review in collaboration with the rest of the editorial team. Reviewer recognition statement: Nature Medicine thanks Naor Bar-Zeev, Randy Cron and Jessica Manson for their contribution to the peer review of this work.
Publisher’s note Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Distribution of the World Health Organization (WHO) Clinical Progression Scale (CPS) at day 14 of patients allocated to treatment with placebo and to treatment with anakinra. Comparison is done by the unadjusted ordinal regression analysis; the odds ratio (OR) and the 95% confidence intervals (CIs) are provided. The exact P value is 3.9 ×10-4. The two tests of the assumptions of the ordinal regression analysis are also provided. Abbreviations CI: confidence interval; ECMO: extracorporeal membrane oxygenation; HFO: high flow oxygen; MV: mechanical ventilation; NIV: non-invasive ventilation; OR: odds ratio; PCR: polymerase chain reaction; P/F: respiratory ratio.
Severe respiratory failure is defined as respiratory ratio-PF < 150 necessitating high flow oxygen/non-invasive ventilation/mechanical ventilation or death) by day 14. Comparison is done by univariate Cox regression analysis. The hazard ratio (HR) and the 95% confidence intervals (CIs) are provided. Abbreviations HFO: high flow oxygen; MV: mechanical ventilation; n: number; P/F: respiratory ratio; SoC; standard-of-care.
Comparison is done by univariate Cox regression analysis. Abbreviations: CI: confidence intervals; HR: hazard ratio; n: number.
Comparison is done by univariate Cox regression analysis. Abbreviations: CI: confidence intervals; HR: hazard ratio; n: number.
Analysis involves only patients who were admitted in the intensive care unit. Comparison is done by univariate Cox regression analysis. Abbreviations: CI: confidence intervals; HR: hazard ratio; n: number.
Comparison is done by univariate Cox regression analysis. Abbreviations: CI: confidence intervals; HR: hazard ratio; n: number.
Comparison is done by univariate Cox regression analysis. Abbreviations: CI: confidence intervals; HR: hazard ratio; n: number.
A, C, E, and G) Receiver operator characteristics (ROC) curves of AST, NLR, CRP and ferritin to predict progression into severe respiratory failure (SRF) or death the first 14 days. The exact P-value of the ROC analysis in panel A is 9.3 ×10-8; in panel C is 5.1 ×10-5; in panel E is 2.7 ×10-7; and in panel G is 1.6 ×10-7. B, D, G and H) Diagnostic performance of AST > 44U/l, NLR > 5.5, CRP > 50 mg/l and ferritin > 700 ng/ml for prognostication of progression into SRF or death by day 14. The selected cut-offs are the Youden indexes for the best trade-off of sensitivity and specificity for each variable. Analysis involved patients for whom all four variables were available at baseline before start of the study drug. Comparisons are done by Mantel-Haenszel test estimating the odds ratio and 95% confidence intervals. The exact P value of the test in panel B is 4.1 ×10-5; in panel F 5.0 ×10-6; and in H 6.5 ×10-4. Abbreviations AUC: area under the curve; AST: aspartate aminotransferase; CI: confidence intervals; CRP: C-reactive protein; n: number of patients; NLR: neutrophil to lymphocyte ratio; NPV: negative predictive value; OR: odds ratio; PPV: positive predictive value.
Σεπ 28
Αναμένεται απάντηση από τον ΕΜΑ
Η έγκαιρη αντιμετώπιση της πνευμονίας από COVID-19 με μια ειδικά στοχευμένη θεραπευτική προσέγγιση με το φάρμακο Anakinra, μείωσε τον κίνδυνο εξέλιξης της νόσου κατά 64% και θανάτου κατά 55%.
Αυτό είναι το βασικό συμπέρασμα της μελέτης SAVE-MOREπου σχεδίασε και συντόνισε η Ελληνική Ομάδα Μελέτης της Σήψης με επικεφαλής τον Καθηγητή Παθολογίας-Λοιμώξεων της Ιατρικής Σχολής του ΕΚΠΑ Ευάγγελος Γιαμαρέλλο – Μπουρμπούλης, με βάση οδηγίες της ειδικής επιτροπής του Ευρωπαϊκού Οργανισμού Φαρμάκων(European Medicines Agency – EMA).
Η μελέτη υλοποιήθηκε σε συνεργασία με 37 κέντρα, στην Ελλάδα (29) και στην Ιταλία (8) και τα αποτελέσματα έχουν κατατεθεί στον Ευρωπαϊκό Οργανισμό Φαρμάκων από τον οποίο αναμένεται απάντηση για την έγκριση ή μη, της ένδειξης του φαρμάκου Anakinra για την νόσο COVID-19.
Τα στοιχεία και τα συμπεράσματα της μελέτης δημοσιεύτηκαν στο περιοδικό Nature Medicine στις 3 Σεπτεμβρίου κάτι που είναι ιδιαιτέρως σημαντικό για την διάχυση της γνώσης παγκοσμίως όσον αφορά την αντιμετώπιση της COVID-19.
Αναλυτικότερα:
Η μελέτη SAVEMORE περιγράφει μία πλήρη στρατηγική της αντιμετώπισης των ασθενών με COVID-19 πνευμονία η οποία έχει δύο στάδια:
Η κλινική εξέλιξη αξιολογήθηκε στην Κλίμακα CPS των 11 σημείων του Παγκόσμιου Οργανισμού Υγείας (ΠΟΥ).
Τα αποτελέσματα – μετά από 28 ημέρες από την έναρξη της θεραπείας – έδειξαν συνολική βελτίωση της κλινικής εξέλιξης των ασθενών που έλαβαν θεραπεία με το φάρμακο anakinra συγκριτικά με τους ασθενείς που έλαβαν θεραπεία με εικονικό φάρμακο κατά 64%.
Η βελτίωση μπορεί να δοθεί συνοπτικά ως εξής:
Η μελέτη SAVE–MORE:
Όπως δήλωσε ο επικεφαλής της έρευνας Καθηγητής Ευάγγελος Ι. Γιαμαρέλλος-Μπουρμπούλης, «πρόκειται για την μοναδική στον κόσμο ολοκληρωμένη μελέτη φάσης ΙΙΙ που έχει δημοσιευτεί σε περιοδικό της εμβέλειας του Nature Medicine.
Εκπροσωπώντας όλη την ομάδα και τα κέντρα στην Ελλάδα και την Ιταλία που εργαστήκαμε σκληρά τους προηγούμενους μήνες αισθανόμαστε δικαιωμένοι και χρήσιμοι γιατί συμβάλαμε στη βελτίωση της φροντίδας πολλών ασθενών μας σε αυτή την κρίσιμη εποχή της πανδημίας.
Έχουμε πλέον την ευκαιρία να μοιραστούμε τα ενθαρρυντικά ευρήματά μας με την διεθνή ιατροφαρμακευτική κοινότητα, συνεργαζόμαστε ήδη στενά με τον ΕΜΑ και συζητάμε και με άλλες ρυθμιστικούς φορείς στην Ελλάδα και σε άλλες χώρες.
Νιώθουμε ότι κάναμε το χρέος μας, ως γιατροί και ερευνητές, απέναντι στους δικούς μας ασθενείς, την χώρα μας, αλλά και όλους όσοι αγωνίζονται σκληρά για να βρουν λύσεις απέναντι στην πανδημία.
Ευχαριστώ όλους
Σημειώσεις:
Tο Anakinra είναι ένα βιοφαρμακευτικό φάρμακο που χρησιμοποιείται για τη θεραπεία της ρευματοειδούς αρθρίτιδας.
Πρόκειται για μια ανασυνδυασμένη έκδοση της πρωτεΐνης ανταγωνιστή του ανθρώπινου υποδοχέα ιντερλευκίνης 1, η οποία εξουδετερώνει τη βιολογική δραστικότητα της ιντερλευκίνης-1α και της ιντερλευκίνης-1β αναστέλλοντας ανταγωνιστικά τη δέσμευσή τους στον υποδοχέα τύπου Ι της ιντερλευκίνης-1 (IL-1RI).
Η ιντερλευκίνη-1 (IL-1) είναι μία βασική προ-φλεγμονώδης κυτοκίνη, η οποία μεσολαβεί σε πολλές κυτταρικές αποκρίσεις, συμπεριλαμβανομένων εκείνων που είναι σημαντικές στην αρθρική φλεγμονή.
Κάτοχος Άδειας Κυκλοφορίας (ΚΑΚ) του Anakinra είναι η εταιρεία Sobi.
-Το Ελληνικό Ινστιτούτο Μελέτης της Σήψης (HISS) – www.sepsis.gr, είναι ένας μη κερδοσκοπικός οργανισμός με έδρα την Αθήνα.
Ξεκίνησε τη δραστηριότητά του τον Μάιο 2006 με στόχο τη διαχείριση, τη συνεργασία, την εκπαίδευση και κυρίως την έρευνα σε θέματα σήψης.
Συντονίζει τις ερευνητικές δράσεις στον τομέα της σήψης και των σοβαρών φλεγμονωδών διαταραχών σε 58 τμήματα Παθολογίας και Μονάδες Εντατικής Θεραπείας (ΜΕΘ) στην Ελλάδα και στο εξωτερικό.
Το Ινστιτούτο έχει χρηματοδοτήσει τη διεξαγωγή περισσότερων από 30 κλινικών μελετών και στο παρελθόν έχει υποστηρίξει περισσότερες από 100 δημοσιεύσεις.
Είναι μέλος και εκπροσωπείται στην Ευρωπαϊκή Συμμαχία για τη Σήψη (EuropeanSepsisAlliance).
Ο Ευάγγελος Ι. Γιαμαρέλλος-Μπουρμπούλης, είναι Καθηγητής Παθολογίας και Λοιμώξεων του Εθνικού και Καποδιστριακού Πανεπιστημίου Αθηνών, Πρόεδρος της Πανευρωπαϊκής Εταιρείας Καταπληξίας (EuropeanShockSociety) και Πρόεδρος του Διοικητικού Συμβουλίου της Ευρωπαϊκής Συμμαχίας κατά της Σήψης (EuropeanSepsisAlliance).
Link μελέτης (NatureMedicine): https://www.nature.com/articles/s41591-021-01499-z
–Τo SuPAR (Soluble urokinase Plasminogen Activating Receptor) είναι η διαλυτή µορφή, µιας πρωτεΐνης (uPAR) που σχετίζεται με κύτταρα του ανοσοποιητικού συστήματος και µπορεί να ανιχνευτεί / μετρηθεί σε διάφορα βιολογικά υγρά, όπως:
-το πλάσµα, τα ούρα και το εγκεφαλονωτιαίο υγρό.
Αυξημένα επίπεδα SuPAR αντανακλούν ενεργοποίηση του ανοσοποιητικού συστήµατος και έχουν αξιολογηθεί ως βιοδείκτης φλεγµονής και βλάβης των οργάνων σε µια σειρά από νοσήµατα, κυρίως στην ανάπτυξη της καρδιαγγειακής νόσου (CVD), όπου το SuPAR µπορεί να συνδέεται και µε την αθηροσκλήρωση σε αρχικό στάδιο.
Με τον όρο διπλά τυχαιοποιημένη («τυφλή») μελέτη εννοείται αφενός ότι ούτε ο ασθενής, ούτε ο γιατρός γνωρίζουν αν δίδεται θεραπεία με το υπό έρευνα φάρμακο, ή με άλλο με το οποίο συγκρίνεται, ή με εικονικό φάρμακο (placebo), κάτι που βοηθά να αποτραπεί η προκατάληψη (ή η μεροληψία) ως προς την αποτελεσματικότητα του υπό έρευνα φαρμάκου και αφετέρου η απόφαση για το ποια θεραπεία/φάρμακο θα δοθεί βασίζεται στην τύχη και όχι σε επιλογή του ερευνητή, ή του γιατρού, έτσι ώστε να κατανέμονται όλοι οι ασθενείς στις διαφορετικές ομάδες μιας μελέτης με παρόμοιο και δίκαιο τρόπο.
| Ερευνητικά κέντρα στην περιοχή της Αττικής |
| 1. Κλινική COVID-19, Γενικό Νοσοκομείο Αθηνών Ο ΕΥΑΓΓΕΛΙΣΜΟΣ (Ιωάννης Καλομενίδης, Καθηγητής Πνευμονολογίας) |
| 2. Δ’ Παθολογική Κλινική, Πανεπιστημιακό Γενικό Νοσοκομείο ΑΤΤΙΚΟΝ, (Αναστασία Αντωνιάδου, Καθηγήτρια Παθολογίας-Λοιμώξεων) |
| 3. Α’ Πανεπιστημιακή Πνευμονολογική Κλινική, Γενικό Νοσοκομείο Νοσημάτων Θώρακος Αθηνών ΣΩΤΗΡΙΑ (Καθηγήτρια Αντωνία Κουτσούκου) |
| 4. Γ’ Πανεπιστημιακή Παθολογική Κλινική, Γενικό Νοσοκομείο Νοσημάτων Θώρακος Αθηνών ΣΩΤΗΡΙΑ (Γαρυφαλλιά Πουλάκου, Επίκουρη Καθηγήτρια Παθολογίας) |
| 5. Θεραπευτική Κλινική, Γενικό Νοσοκομείο Αθηνών ΑΛΕΞΑΝΔΡΑ, (Ευάγγελος Κωστής, Διευθυντής ΕΣΥ) |
| 6. Α’ Πανεπιστημιακή Παθολογική Κλινική, Γενικό Νοσοκομείο Αθηνών ΛΑΪΚΟ, (Μιχαήλ Σαμάρκος, Αναπληρωτής Καθηγητής Παθολογίας- Λοιμώξεων) |
| 7. Α’ Παθολογική Κλινική, Γενικό Νοσοκομείο Αθηνών Γ. ΓΕΝΝΗΜΑΤΑΣ (Γεώργιος Αδάμης, Διευθυντής ΕΣΥ) |
| 8. Παθολογική Κλινική, Γενικό Νοσοκομείο Νοσημάτων Θώρακος Αθηνών ΣΩΤΗΡΙΑ (Αικατερίνη Αργυράκη, Επιμελήτρια Α’) |
| 9. Α΄ Παθολογική Κλινική, Γενικό Νοσοκομείο Αθηνών ΚΟΡΓΙΑΛΕΝΕΙΟ-ΜΠΕΝΑΚΕΙΟ Ε.Ε.Σ. (Βασιλική Τζαβάρα, Διευθύντρια ΕΣΥ) |
| 10. Γ΄ Παθολογική Κλινική, Γενικό Νοσοκομείο Αθηνών ΚΟΡΓΙΑΛΕΝΕΙΟ-ΜΠΕΝΑΚΕΙΟ Ε.Ε.Σ (Μαρία Χίνη, Διευθύντρια ΕΣΥ) |
| 11. 2η Πνευμονολογική Κλινική Γενικό Νοσοκομείο Νοσημάτων Θώρακος Αθηνών ΣΩΤΗΡΙΑ (Αγγελική Ράπτη, Διευθύντρια ΕΣΥ) |
| 12. 4η Πνευμονολογική Κλινική Γενικό Νοσοκομείο Νοσημάτων Θώρακος Αθηνών ΣΩΤΗΡΙΑ (Γιώργος Τσουκαλάς, Διευθυντής ΕΣΥ) |
| 13. 5η Πνευμονολογική Κλινική Γενικό Νοσοκομείο Νοσημάτων Θώρακος Αθηνών ΣΩΤΗΡΙΑ (Αικατερίνη Δημάκου, Διευθύντρια ΕΣΥ) |
| 14. 10η Πνευμονολογική Κλινική Γενικό Νοσοκομείο Νοσημάτων Θώρακος Αθηνών ΣΩΤΗΡΙΑ (Ηλίας Καΐνης, Διευθυντής ΕΣΥ) |
| 15. Α’ Παθολογική Κλινική Γενικό Νοσοκομείο Νέας Ιωνίας ΚΩΝΣΤΑΝΤΟΠΟΥΛΕΙΟ-ΠΑΤΗΣΣΙΩΝ (Αικατερίνη Μασγάλα-Σεφερλή, Διευθύντρια ΕΣΥ) |
| 16. Παθολογική Κλινική, Γενικό Νοσοκομείο Αθηνών ΕΛΠΙΣ (Αρχοντούλα Φράγκου, Διευθύντρια ΕΣΥ) |
| 17. Α’ Παθολογική Κλινική, Γενικό Νοσοκομείο Ελευσίνας ΘΡΙΑΣΙΟ (Στυλιανή Συμπάρδη, Διευθύντρια ΕΣΥ) |
| 18. Β’ Παθολογική Κλινική, Γενικό Νοσοκομείο Ελευσίνας ΘΡΙΑΣΙΟ (Ζωή Αλεξίου, Διευθύντρια ΕΣΥ) |
| 19. Α’ Παθολογική Κλινική, Γενικό Νοσοκομείο Βούλας ΑΣΚΛΗΠΙΕΙΟ (Ιωάννης Μπληζιώτης, Επιμελητής ΕΣΥ) |
| 20. Β’ Παθολογική Κλινική, Γενικό Νοσοκομείο Πειραιά ΤΖΑΝΕΙΟ (Γεώργιος Χρύσος, Διευθυντής ΕΣΥ) |
| Ερευνητικά κέντρα εκτός Αθηνών |
| 1. Α’ Παθολογική Κλινική, Γενικό Νοσοκομείο Θεσσαλονικής ΑΧΕΠΑ (Συμεών Μεταλλίδης, Αναπληρωτής Καθηγητής Παθολογίας-Λοιμωξιολογίας) |
| 2. Β’ Προπαιδευτική Παθολογική Κλινική Γενικό Νοσοκομείο Θεσσαλονίκης ΙΠΠΟΚΡΑΤΕΙΟ (Μιχάλης Δούμας, Καθηγητής Παθολογίας) |
| 3. Α’ Παθολογική Κλινική, Γενικό Νοσοκομείο Θεσσαλονίκης ΠΑΠΑΓΕΩΡΓΙΟΥ (Γλυκερία Τζατζάγου, Διευθύντρια ΕΣΥ) |
| 4. Γ΄ Πανεπιστημιακή Παθολογική Κλινική Γενικό Νοσοκομείο Θεσσαλονίκης ΠΑΠΑΓΕΩΡΓΙΟΥ (Βασίλειος Κωτσής, Καθηγητής Παθολογίας) |
| 5. Παθολογική Κλινική, Πανεπιστημιακό Γενικό Νοσοκομείο Πατρών ΠΑΝΑΓΙΑ Η ΒΟΗΘΕΙΑ, (Καρολίνα Ακινόσογλου, Επίκουρη Καθηγήτρια Παθολογίας) |
| 6. Παθολογική Κλινική, Πανεπιστημιακό Γενικό Νοσοκομείο Λάρισας, (Γιώργος Νταλέκος, Καθηγητής Παθολογίας) |
| 7. Β΄ Παθολογική Κλινική, Πανεπιστημιακό Γενικό Νοσοκομείο Αλεξανδρούπολης (Περικλής Παναγόπουλος, Επίκουρος Καθηγητής Παθολογίας) |
| 8. Α’ Παθολογική Κλινική, Γενικό Νοσοκομείο Ιωαννίνων, (Χαράλαμπος Μηλιώνης, Καθηγητής Παθολογίας) |
| 9. Πνευμονολογική Κλινική, Γενικό Νοσοκομείο Κέρκυρας (Ηλίας Παπανικολάου, Διευθυντής ΕΣΥ) |
| Ερευνητικά Κέντρα στην Ιταλία |
| 1. Κλινική Λοιμωξιολογίας,Ospedale Policlinico San Martino IRCCS και Τμήμα Επιστημών Υγείας, Πανεπιστήμιο Γενεύης (PI: Prof. M. Bassetti) |
| 2. Παθολογική Κλινική, Ινστιτούτο Spallanzani της Ρώμης (PI: G. Ippolito) |
| 3. Dipartimento Scienze di Laboratorio e Infettivologiche – Fondazione Policlinico Gemelli IRCCS, (PI: Prof. M. Fantoni) |
| 4. Spedali Civili, Brescia ASST Spedali Civili Hospital, ΠανεπιστήμιοτηςΜπρέσια (PI: Prof. F. Castelli) |
| 5. Τμήμα Λοιμωδών – Τροπικών Νοσημάτων και Μικροβιολογίας, IRCSS Sacro Cuore Hospital, Negrar, Verona (PI: Prof. Z. Bissofi) |
| 6. Μονάδα Ανοσολογίας, Ρευματολογίας, Αλλεργίας και Σπάνιων Παθήσεων (UnIRAR), IRCCS Ospedale San Raffaele & Vita-Salute San Raffaele University, Milan (PI: Prof. L. Dagna) |
| 7. Ερευνητικό Νοσοκομείο Humanitas, Μιλάνο (PI: Prof. C. Selmi) |
| 8. ΠαθολογικήΚλινική, Hospital of Jesolo (PI: Dr. F.Serino) |
ΠΗΓΗ:https://www.ygeiamasnews.gr/astheneies/epidimies/67074/elliniki-protasi-gia-tin-antimetopisi-tis-pneymonias-covid-19-deixnei-kata-64-synoliki-veltiosi-kai-55-meiosi-ton-thanaton/
Σεπ 27
Dr. Charles Hoffe found 62% percent of patients who received COVID mRNA jab test positive for blood clots.
‘The concern…is those people will probably all develop right-sided heart failure within three years and die because they now have increased vascular resistance through their lungs.’
A Canadian doctor demands further study into the link between Covid-19 vaccines and blood clots after his research found clots in a majority of vaccinated patients, some of whom he says could be dead within three years.
During a Zoom meeting with other medical professionals, Dr. Charles Hoffe explained he’s been running a study on recently vaccinated patients, having them take D-dimer blood tests to determine whether they have blood clots.
Click here for YouTube version
“So far I’ve got 62 percent positive elevated D-dimer, which means that the blood clots are not rare,” Hoffe informed fellow physicians.
“That’s what the so-called experts keep telling us: ‘The clots are rare.’ The big ones are rare, but the small ones are clearly happening in the majority of people, 62 percent.”
Dr. Hoffe says the clots, which could number in the thousands and are hard to detect due to their microscopic size, are caused by messenger RNA molecules in the vaccine which cause spike proteins to form, which in turn attach to the cell walls of a cell impeding blood flow and damaging blood vessels.
So normally the cells that surround your blood vessels have to be very, very smooth to enable good and unimpeded flow of blood, but as soon as you’ve got all these little spike proteins that become part of the cell wall it’s now a rough surface. It’s going to be like a very coarse sandpaper. It’s now what the platelets are going to interpret as a damaged vessel. It’s no longer smooth. It’s rough. So clotting is inevitable because the platelets that come down that vessel are going to hit a rough spot and assume this must be a damaged vessel. This vessel needs to be blocked to stop the bleeding. That’s how our clotting works. So…because of this and because of the nature of this, clots are inevitable, because of these spike proteins in the capillary networks.
The damaged vessels don’t regenerate like other tissues and organs and instead remain permanently damaged, and because the clots are so tiny and scattered they bypass typical medical detection methods.
Watch – Alex Jones reports: Deadly Blood Clots Develop In 62% of People Receiving COVID Vaccine
Hoffe, who was put under a gag order by the Canadian government after warning about the concerning trend, says this process could be why nearly all vaccinated people experience similar negative side effects.
“In fact, all of the frequent side effects of the shot, which are headache, nausea, dizziness, fatigue, could all be signs of cerebral thrombosis on a capillary level. I mean…literally you could be having thousands and thousands of tiny, tiny little clots in your brain that won’t show on a scan, but they will give you those exact symptoms,” Hoffe stated.
The doctor also detailed how six of his vaccinated patients have all suffered “reduced effort tolerance,” meaning they get tired quicker while doing normal everyday activities.
“So I believe that these people blocked up thousands and thousands of capillaries in their lungs, in these six people. So I believe these people now have permanently damaged lungs because…I mean, that’s why they get out of breath,” Dr. Hoffe related.
Hoffe says the damaged vessels and damaged lung tissue are a big problem that would lead to “pulmonary artery hypertension,” or high blood pressure in the lungs and death within three years due to increased vascular resistance.
Covid-19 Vaccinated Patients May Develop Fatal Heart Damage, says Doctor
“The concern is: because these vessels are now permanently damaged in a person’s lungs, when the heart tries to pump blood through all those damaged vessels there’s increased resistance trying to pump the blood through those lungs.”
“So those people are going to develop something called ‘pulmonary artery hypertension’ – high blood pressure in their lungs, and the concern with that is that those people will probably all develop right-sided heart failure within three years and die because they now have increased vascular resistance through their lungs.”
During the virtual meeting, other doctors in the Zoom call appeared shocked and somber at Dr. Hoffe’s tragic news.
If Hoffe’s research turns out to be right, the Covid vaccine could be the mass-culling depopulation event the globalists have been waiting for.
Let’s hope to God Dr. Hoffe’s theory somehow turns out to be incorrect.
Σεπ 26
Αλεξάντρ Σολζενίτσιν
«Για μένα η πίστη είναι το θεμέλιο και το στήριγμα της ζωής»
Εξουσιάζετε τους ανθρώπους μέχρι τη στιγμή που θα τους πάρετε τα πάντα.
Όταν όμως τους αφήσετε χωρίς τίποτα, τους χάσατε!
Είναι ελεύθεροι.
Πριν από μισό αιώνα περίπου, ενώ ήμουν ακόμα παιδί, θυμάμαι ότι άκουγα αρκετούς ηλικιωμένους να δίνουν την ακόλουθη εξήγηση για τις μεγάλες καταστροφές που είχαν πλήξει τη Ρωσία: «Οι άνθρωποι ξέχασαν τον Θεό. Γι’ αυτό και συνέβη όλο αυτό».
Από τότε έχω περάσει σχεδόν πενήντα χρόνια που εργάζομαι για την ιστορία της Επανάστασής μας. Όλα αυτά τα χρόνια έχω διαβάσει εκατοντάδες βιβλία, έχω συγκεντρώσει εκατοντάδες προσωπικές μαρτυρίες, και έχω ήδη συνεισφέρει οκτώ τόμους δικούς μου στην προσπάθεια της εκκαθάρισης από τα συντρίμμια που άφησε πίσω η αναταραχή. Αλλά αν μου ζητούσαν σήμερα να διατυπώσω όσο πιο συνοπτικά γίνεται την κύρια αιτία της καταστροφικής επανάστασης που κατάπιε περίπου εξήντα εκατομμύρια του λαού μας, δεν θα μπορούσα να το θέσω με μεγαλύτερη ακρίβεια από ό, τι να επαναλάβω: «Οι άνθρωποι ξέχασαν τον Θεό. Γι’ αυτό και συνέβη όλο αυτό».
Οι αδυναμίες της ανθρώπινης συνείδησης, που έχει στερηθεί της θείας της διάστασης, ήταν ένας καθοριστικός παράγοντας σε όλα τα μεγάλα εγκλήματα αυτού του αιώνα…. Το ίδιο ελάττωμα, το ελάττωμα μιας συνείδησης που δεν έχει τη θεϊκή διάσταση, εκδηλώθηκε μετά τον Β΄ Παγκόσμιο Πόλεμο, όταν η Δύση ενέδωσε στον σατανικό πειρασμό της «πυρηνικής ομπρέλας». Ο σημερινός κόσμος έχει φτάσει σε μια φάση που, σε προηγούμενους αιώνες, θα είχε περιγραφεί με την κραυγή: “Αυτή είναι η Αποκάλυψη!”
Ο Ντοστογιέφσκι προειδοποίησε ότι «μεγάλα γεγονότα θα μπορούσαν να έρθουν επάνω μας και να μας βρουν πνευματικά απροετοίμαστους». Αυτό ακριβώς συνέβη. Και προέβλεψε ότι “ο κόσμος θα σωθεί μόνο αφού έχει καταληφθεί από τον δαίμονα του κακού”…
Ήταν ο Ντοστογιέφσκι, και πάλι, ο οποίος άντλησε από τη Γαλλική Επανάσταση και το ολοφάνερο μίσος για την Εκκλησία το δίδαγμα ότι «η επανάσταση πρέπει κατ’ ανάγκην να αρχίσει με τον αθεϊσμό». Αυτό είναι απολύτως αληθινό. Αλλά ο κόσμος δεν είχε γνωρίσει ποτέ πριν, μια τόσο μεγάλη ασέβεια οργανωμένη, στρατιωτικοποιημένη και επίμονα κακόβουλη…
Στην δεκαετία του 1920 στην ΕΣΣΔ είδαμε μια αδιάσπαστη πομπή θυμάτων και μαρτύρων μεταξύ του Ορθοδόξου κλήρου. Δύο μητροπολίτες εκτελέστηκαν, ένας από τους οποίους, ο Βενιαμίν της Αγ. Πετρούπολης, ο οποίος εξελέγη με τη λαϊκή ψήφο της μητρόπολής του. Ο ίδιος ο πατριάρχης Τύχων πέρασε από τα χέρια της GPU Cheka και πέθανε ύστερα κάτω από ύποπτες συνθήκες. Αρχιεπίσκοποι και Επίσκοποι έχασαν τη ζωή τους. Δεκάδες χιλιάδες ιερείς, μοναχοί και μοναχές, οι οποίοι πιέστηκαν από τους Τσεκιστές να αρνηθούν το Λόγο του Θεού, βασανίστηκαν, εκτελέστηκαν σε κελιά, στάλθηκαν σε στρατόπεδα, εξορίστηκαν στην έρημη τούνδρα του απώτατου βορρά ή βρέθηκαν να τριγυρνάνε στους δρόμους σε μεγάλη ηλικία χωρίς φαγητό ή καταφύγιο. Όλοι αυτοί οι Χριστιανοί μάρτυρες πέθαναν για την πίστη. Οι περιπτώσεις αποστασίας ήταν λίγες. Σε δεκάδες εκατομμύρια λαϊκών, εμποδίστηκε η πρόσβαση στην Εκκλησία και τους απαγορεύθηκε να αναθρέψουν τα παιδιά τους στην πίστη: πιστοί γονείς αποξενώθηκαν από τα παιδιά τους και ρίχτηκαν στη φυλακή, ενώ τα παιδιά τους αρνήθηκαν την πίστη με απειλές και ψέματα …
Τώρα, βέβαια, οι αθεϊστές δάσκαλοι στη Δύση φέρνουν στη νεότερη γενιά ένα πνεύμα μίσους. Και εδώ πάλι βλέπουμε το αποτέλεσμα μιας παγκόσμιας διαδικασίας να δίνει τα ίδια αποτελέσματα, και για άλλη μια φορά για τον ίδιο λόγο: Οι άνθρωποι έχουν ξεχάσει τον Θεό.
Στις αδικαιολόγητες ελπίδες των δύο τελευταίων αιώνων, οι οποίες μας έφεραν στο χείλος του πυρηνικού και μη πυρηνικού θανάτου, μπορούμε να προτείνουμε μόνο μια στερεά αναζήτηση για το στοργικό χέρι του Θεού, το οποίο απαρνηθήκαμε..
***
Να μη ζούμε με ψέματα
Αλεξάντρ Σολζενιτσιν
Έχουμε χάσει τόσον απελπιστικά την ανθρωπιά μας, ώστε για τις σημερινές υλικές αξίες, παραδίνουμε όλες τις αρχές μας, τη ψυχή μας, όλες τις προσπάθειες των προγόνων μας, όλες τις δυνατότητες για τους απογόνους μας, φτάνει μόνο να μη χαλάσουμε τη κακομοιριασμένη μας ζωή. Δε μας έχει απομείνει μήτε σταθερότητα, μήτε περηφάνια, μήτε φλόγα στη καρδιά. Δε φοβόμαστε καν τον γενικό θάνατο από την ατομική ενέργεια, δε φοβόμαστε τον Γ’ Παγκόσμιο Πόλεμο (μπορεί και να τα καταφέρουμε να κρυφτούμε σε καμμιά χαραμάδα), το μόνο που φοβόμαστε είναι οι θαρραλέες πολιτικές πράξεις. Φτάνει μόνο να μη μας ξεμοναχιάσουν από το κοπάδι, φτάνει μόνο να μη κάνουμε κανένα βήμα μόνοι μας και βρεθούμε ξαφνικά χωρίς την άσπρη μας φρατζόλα. Είναι ωραία λοιπόν να ζεις βολικά σ’ όλη σου τη ζωή, δε μπορείς να ξεφύγεις από το περιβάλλον, από τις κοινωνικές συνθήκες, το “είναι” καθορίζει τη συνείδηση. Εμείς τί ρόλο παίζουμε; Εμείς δε μπορούμε να κάνουμε τίποτε!
Κι όμως μπορούμε τα πάντα! αλλά αραδιάζουμε ψέμματα στον εαυτό μας, για να τονε καθησυχάσουμε. Δε φταίνε κείνοι για όλα. Φταίμε μεις οι ίδιοι, μόνον εμείς! Θα πείτε: “Ναι, πραγματικά τίποτα δε μπορούμε να σοφιστούμε! Μας φιμώσανε το στόμα, δε μας ακούνε, μήτε καν μας ρωτάνε. Πώς να τους αναγκάσουμε να μας ακούσουνε λοιπόν”; Ώστε λοιπόν ο κύκλος έκλεισε; Και διέξοδος δεν υπάρχει στ’ αλήθεια; Δε μένει λοιπόν παρά να περιμένουμε άπραγοι μήπως και γίνει κάτι από μόνο του;
Αυτό όμως δε θα ξεκολλήσει ποτέ από πάνω μας μόνο του, αν όλοι το παραδεχόμαστε κάθε μέρα, το υμνούμε και το εδραιώνουμε συνέχεια, αν δεν απομακρυνθούμε τουλάχιστον από το πιο ευαίσθητο σημείο του. Από το ΨΕΜΜΑ!
Όταν η βία εισβάλει στην ειρηνική ζωή των ανθρώπων, το πρόσωπό της φλέγεται από αυτοπεποίθηση, το γράφει καθαρά στη σημαία της και κραυγάζει: “Εγώ είμαι η ΒΙΑ! Φύγετε, παραμερίστε, θα σας κάνω λιώμα”! Η βία όμως γερνά γρήγορα, ύστερα από μερικά χρόνια δεν είναι πια σίγουρη για τον εαυτό της και για να κρατηθεί, για να ‘χει μούτρα να εμφανίζεται, καλεί για σύμμαχό της το ΨΕΜΜΑ. Γιατί δεν έχει τίποτ’ άλλο να τη καλύψει και το ΨΕΜΜΑ, για να στηριχτεί έχει ανάγκη από τη ΒΙΑ. Αλλά η ΒΙΑ δεν ακουμπά κάθε μέρα, μήτε σε κάθε ώμο το βαρύ της χέρι. Το μόνο που ζητά είναι υποταγή και καθημερινή υποταγή στο ΨΕΜΜΑ. Κι αυτό είναι καθαρή δουλοπρέπεια.
Εδώ ακριβώς είναι το πιο απλό, το πιο προσιτό, το πιο περιφρονημένο από μας, κλειδί για τη λύτρωση μας: Η ΑΤΟΜΙΚΗ ΜΗ ΣΥΜΜΕΤΟΧΗ ΜΑΣ ΣΤΟ ΨΕΜΜΑ! Τί κι αν σκέπασε τα πάντα, τί κι αν κυριαρχεί παντού το ψέμμα; Εμείς θα στηριχτούμε σε τούτο το ελάχιστο: ΔΕ ΘΑ ΥΠΑΡΧΕΙ ΜΕ ΤΗ ΔΙΚΗ ΜΟΥ ΣΥΜΜΕΤΟΧΗ! Αυτό είναι το πρώτο άνοιγμα στον δήθεν κρίκο της απραξίας μας. Εύκολο για μας, καταστρεπτικό για το ΨΕΜΜΑ. Όταν οι άνθρωποι ξεκόβουν απ’ αυτό, απλούστατα παύει να υπάρχει. Σαν τη ψώρα, το ΨΕΜΜΑ, μπορεί να υπάρχει μόνο στους ανθρώπους!
Δε μας καλούν, δεν έχουμε ωριμάσει ακόμα τόσο, ώστε να βγούμε στη πλατεία και να βροντοφωνάξουμε την αλήθεια. Δε μας ρωτούν να πούμε φωναχτά τις σκέψεις μας, ίσως δε ξέρουμε ποια είναι η πραγματική αλήθεια. Ξέρουμε όμως ποιο είναι το ΨΕΜΜΑ. Εξάλλου μπορούμε ν’ αρνηθούμε να λέμε αυτό που δεν σκεφτόμαστε! Εύκολος δρόμος για τη διαμορφωμένη μας οργανική δειλία και πιο προσιτός.
Ο δρόμος είναι: Να μην υποστηρίξουμε συνειδητά σε τίποτε το ΨΕΜΜΑ! Αφού συνειδητοποιήσουμε τα γαγγραινιασμένα σύνορά του, ας αποτραβηχτούμε απ’ αυτά. Δε θα συγκολλήσουμε τα νεκρά κοκκαλάκια και τα λέπια της Κυρίαρχης Ιδεολογίας, δε θα μπαλώσουμε τα σάπια κουρέλια. Τότε θ’ απορήσουμε πόσο γρήγορα κι ανήμπορα θα καταρρεύσει το ΨΕΜΜΑ. Το γυμνό, θα φανεί επιτέλους γυμνό στον κόσμο.
Μένει λοιπόν να διαλέξει ο καθείς μας μέσα στη δειλία του: Θα μείνει συνειδητά υπηρέτης του ψέμματος (φυσικά όχι από συμπάθεια), για να βγάλει το ψωμάκι της οικογένειάς του και ν’ αναθρέψει τα παιδιά του στο πνεύμα της ψευτιάς ή ήρθε η ώρα να τ’ αποτινάξει πάνωθέ του και να γίνει άνθρωπος τίμιος, άξιος σεβασμού και των παιδιών του και των συγχρόνων του; Αν δεχτεί το δεύτερο τότε από κείνη τη μέρα:
* δε θα γράψει ποτέ, δε θα υπογράψει ποτέ, δε θα δημοσιεύσει ποτέ, με κανένα τρόπο, μήτε μια φράση που διαστρεβλώνει την αλήθεια.
* δε θα προφέρει καμμιά τέτοια φράση ούτε σε ιδιαίτερη συζήτηση, ούτε μπροστά σε κόσμο, ούτε από δική του προαίρεση, ούτε όταν του το υπαγορεύουν άλλοι, ούτε όταν κάνει τον διαφωτιστή, τον δάσκαλο, τον καθηγητή, τον παιδαγωγό ή όταν υποδύεται κάποιο θεατρικό ρόλο.
* δε θ’ απεικονίσει, δε θα ενισχύσει, δε θα διαδώσει με τη ζωγραφική, τη γλυπτική, τη φωτογραφία, τη τεχνητή διαστρεβλωμένη αλήθεια, όταν την αντιλαμβάνεται.
* δε θ’ αναφέρει, ούτε προφορικά, ούτε γραπτά, κανένα “καθοδηγητικό” τσιτάτο για να γίνει αρεστός ή για να εξασφαλιστεί ή για να πετύχει μια δουλειά του, αν δε συμμερίζεται απόλυτα την αναφερόμενη σκέψη ή αν η σκέψη αυτή είναι εντελώς άσχετη με τη συγκεκριμένη περίπτωση.
* δε θα επιτρέψει να τον αναγκάσουν να πάει σε διαδήλωση ή συγκέντρωση, αν αυτές είναι αντίθετες προς τις αρχές της αλήθειας, δε θ’ αγγίξει στα χέρια του πανό ή σύνθημα με τ’ οποίο δε θα συμφωνεί απόλυτα.
* δε θα σηκώσει το χέρι ψηφίζοντας μια πρόταση που δε συμμερίζεται απόλυτα, δε θα ψηφίσει μήτε φανερά, μήτε κρυφά, πρόσωπα που τα θεωρεί ανάξια ή ύποπτα.
* δε θα επιτρέψει να τον αναγκάσουν να πάρει μέρος σε συνέλευση, όπου είναι βέβαιο πως θα γίνει αναγκαστική και διαστρεβλωμένη συζήτηση της υπόθεσης.
* θα εγκαταλείψει αμέσως τη συνεδρίαση, τη συνέλευση, τη διάλεξη, τη παράσταση, θεατρική ή κινηματογραφική, μόλις ακούσει από τον ρήτορα ή τον ηθοποιό, ένα ψέμμα, ιδεολογικές ανοησίες ή ξεδιάντροπη προπαγάνδα.
* δε θα γίνει συνδρομητής, ούτε θ’ αγοράσει ποτέ μιαν εφημερίδα ή ένα περιοδικό, όπου διαστρεβλώνονται οι πληροφορίες κι αποκρύπτονται τα βασικά γεγονότα.
Με μια λέξη, δε θα δεχτεί ν’ αρκεστεί σε ημίμετρα, σε μιαν εποχή διαστημική, τη στιγμή που μπορεί να ‘χει τα πρότυπά τους.![]()
Δεν απαρίθμησα εδώ φυσικά όλες τις δυνατές κι απαραίτητες αρνήσεις ψέμματος. Εκείνος όμως που θ’ αρχίσει να καθαρίζει τον εαυτό του με το καθαρό του βλέμμα θα μπορέσει εύκολα να ξεχωρίσει κι άλλες τέτοιες περιπτώσεις.
Ναι, στις αρχές τα πράγματα δε θα πάνε καλά. Κάποιοι ίσως χάσουνε προσωρινά τις δουλειές τους. Για τους νέους που θα θελήσουν να ζήσουν ακολουθώντας την αλήθεια, -αυτή θα κάνει τη νέα τους ζωή πιο δύσκολη στην αρχή, αφού και τα μαθήματα που διδάσκονται είναι γεμάτα ψέμματα-, πρέπει να διαλέξουν. Όποιος όμως θέλει να ‘ναι τίμιος, δε θα πρέπει να θέσει θέμα επιλογής. Γιατί δε περνά μέρα που ο καθείς μας ακόμα και στις πιο ακίνδυνες τεχνικές επιστήμες, πρέπει να κάνει ένα τουλάχιστον βήμα απ’ αυτά που προαναφέραμε, προς όφελος της αλήθειας ή προς το ψέμμα, προς το μέρος της πνευματικής ανεξαρτησίας ή της πνευματικής δουλοπρέπειας. Εκείνος που δεν θα ‘χει το θάρρος να υπερασπιστεί τη ψυχή του, ας μη περηφανεύεται για τις προοδευτικές του ιδέες, ας μη καυχιέται πως είναι ακαδημαϊκός ή καλλιτέχνης του λαού, τιμημένος κοινωνικός παράγων ή στρατηγός. Ας πει μόνο στον εαυτό του: “Είμαι δειλός, υποζύγιο, μου φτάνει μόνο να ‘μαι χορτάτος και να μη κρυώνω”!
Αλήθεια είναι πως ο δρόμος αυτός θα ‘ναι δύσκολος! Μα είναι πιο εύκολος από την αυτοπυρπόληση, τις απεργίες πείνας, τις απεργιακές κινητοποιήσεις, τη βία πάνω στη βία, τα ναρκωτικά, τη μέθη, τη φυγή, τη παθητική αντίδραση. Τί να φοβηθείς εξάλλου πιότερο από ένα πυρηνικόν ολοκαύτωμα ή τη καταστροφή του περιβάλλοντος -ακόμα κι αν επιζήσεις.
Οι λαοί του Βιετ-Ναμ του Αφγανιστάν, της Τσεχοσλοβακίας, της Καμπότζης, μας δείξανε πόσο μπορούνε και δαγκώνουνε κι οι μικροί τους μεγάλους. Πως το λιοντάρι χρειάζεται το ποντίκι, αλλά και πρέπει να το φοβάται. Μπορεί κανείς ν’ αντιμετωπίσει και τα τανκς με στήθος γυμνό, αρκεί να ‘χει καρδιά.
Ο δρόμος δε θα ‘ναι εύκολος μα θα ‘ναι ο ευκολότερος δυνατός. Δεν είναι εύκολη η εκλογή για το σώμα μα είναι η μοναδική εκλογή για τη ψυχή. Εξάλλου υπάρχουνε μερικές δεκάδες ανθρώπων σ’ όλο τον κόσμο που ζούνε μ’ αυτές τις αρχές. αν θα γίνουμε δεκάδες, εκατοντάδες, χιλιάδες, δε θ’ αναγνωρίζουμε πια τις χώρες μας.
Αν δειλιάσουμε, ας μη παραπονιόμαστε πια πως δε μας αφήνουν ν’ ανασάνουμε, -εμείς οι ίδιοι δεν αφήνουμε τον εαυτό μας ν’ ανασάνει! Ας σκύψουμε κι άλλο τα κεφάλια μας, ας περιμένουμε και τ’ αδέλφια μας οι βιολόγοι θα βοηθήσουν εκείνους να πετύχουνε το διάβασμα των σκέψεών μας και τη τροποποίηση των γονιδίων μας. Ίσως να κάνουνε σε λίγο και “μάρκετινγκ” πάνω στα συναισθήματά μας και στο πως θα μας “κοιμίζουνε” καλύτερα.
Αν δειλιάσουμε και σ’ αυτό, τότε είμαστε τιποτένιοι, δεν έχουμεν ελπίδα σωτηρίας και για μας ταιριάζουν οι γεμάτοι περιφρόνηση στίχοι του Πούσκιν:
“Τί να τα κάνουν τα κοπάδια, τα δώρα της λευτεριάς;
– – – – – – – – – – – – – – – – – – – – – – – – – – – – – – – –
Από γενιά σε γενιά, κληρονομιά τους είναι
ο ζυγός με τα κουδουνάκια και το μαστίγιο!”
ΠΗΓΗ:http://trelogiannis.blogspot.com/2021/09/blog-post_861.html?m=1
Σεπ 26
Δείτε το βίντεο του Dr Zelenco τα λέει όλα όσα δεν πρέπει να ξέρετε:
was issued September 10th 2021
http://https://www.bitchute.com/video/tDUmw5pSDK4n/
JTA — His rise was meteoric and his fall just as sudden.
Dr. Vladimir “Zev” Zelenko, an Orthodox Jewish doctor who rose to fame in March while promoting a cocktail of drugs he claimed had successfully treated coronavirus – including one that US President Donald Trump said Monday he is taking himself, despite the drug’s potentially dangerous side effects – has announced that he is leaving the Jewish community where he has practiced medicine for decades.
In a video shared by the Orthodox news site Yeshiva World News, Zelenko announced he would leave Kiryas Joel, the town north of New York City where, until the coronavirus pandemic, he was known as a beloved community doctor.
“Things have happened,” he said speaking directly to the camera. “I’ve decided that it’s time for me to move on. I’m not sure yet what I’m going to do.”
The announcement comes after Zelenko was accused by community leaders of spreading disinformation about the rate of coronavirus infection in Kiryas Joel, leading to discrimination against residents of the village. Zelenko is also being investigated by a federal prosecutor over his claim that a study of the drugs he promoted had won approval from the Food and Drug Administration.
Leaders of the Kiryas Joel community spoke out publicly against Zelenko in an open letter in March.
“We the undersigned institutions strongly believe that the predictions presented by Dr. Zelenko have been proven false and are not supported by the overall medical establishment, specifically in his wild conclusions as to the spread of the virus in our community,” the village’s office of emergency management, a partnership of several community organizations and government agencies formed to respond to the COVID-19 crisis, wrote in an open letter.
The letter was written to contradict Zelenko’s claims, which he promoted in videos posted to YouTube, that 90% of the Kiryas Joel community would be infected with COVID-19.
“These measures have, thanks to the Almighty, resulted in a rate of 90% of the community being healthy, the opposite of Dr Zelenko’s outrageous prediction of a 90% infection rate,” they wrote, referring to the closure of the community’s synagogues, schools, and other buildings
ΠΗΓΗ:https://www.timesofisrael.com/jewish-md-who-promoted-virus-cocktail-leaving-community-where-he-tested-it/
Πρόσφατα Σχόλια